Scandio, con simbolo Sc e numero atomico 21, è facilmente solubile in acqua, può interagire con l'acqua calda e scurisce facilmente in aria. La sua valenza principale è +3. Viene spesso miscelato con gadolinio, erbio e altri elementi, con una bassa resa e un contenuto di circa lo 0,0005% nella crosta terrestre. Lo scandio è spesso utilizzato per produrre vetri speciali e leghe leggere ad alta temperatura.
Attualmente, le riserve accertate di scandio nel mondo ammontano a sole 2 milioni di tonnellate, il 90-95% delle quali è contenuto in minerali di bauxite, fosforite e ferro-titanio, e una piccola parte in minerali di uranio, torio, tungsteno e terre rare, distribuiti principalmente in Russia, Cina, Tagikistan, Madagascar, Norvegia e altri paesi. La Cina è molto ricca di risorse di scandio, con enormi riserve minerarie legate a questo minerale. Secondo statistiche incomplete, le riserve di scandio in Cina ammontano a circa 600.000 tonnellate, contenute in giacimenti di bauxite e fosforite, giacimenti di tungsteno in porfido e vene di quarzo nella Cina meridionale, giacimenti di terre rare nella Cina meridionale, giacimenti di ferro e terre rare di Bayan Obo nella Mongolia Interna e giacimento di magnetite di vanadio e titanio di Panzhihua nel Sichuan.
A causa della scarsità di scandio, anche il suo prezzo è molto alto e, al suo apice, è arrivato a 10 volte il prezzo dell'oro. Sebbene il prezzo dello scandio sia sceso, è ancora quattro volte superiore a quello dell'oro!
Alla scoperta della storia
Nel 1869, Mendeleev notò una differenza nella massa atomica tra il calcio (40) e il titanio (48), e predisse l'esistenza di un elemento con massa atomica intermedia non ancora scoperto. Previde che il suo ossido fosse X₂O₅. Lo scandio fu scoperto nel 1879 da Lars Frederik Nilson dell'Università di Uppsala in Svezia. Lo estrasse dalla miniera d'oro nero raro, un minerale complesso che contiene 8 tipi di ossidi metallici. Ha estrattoossido di erbio (III)dal minerale d'oro nero raro, e ottenutoossido di itterbio (III)da questo ossido, e c'è un altro ossido di elemento più leggero, il cui spettro mostra che si tratta di un metallo sconosciuto. Questo è il metallo previsto da Mendeleev, il cui ossido èSc₂O₃Il metallo scandio stesso è stato prodotto dacloruro di scandiomediante fusione elettrolitica nel 1937.
Mendeleev
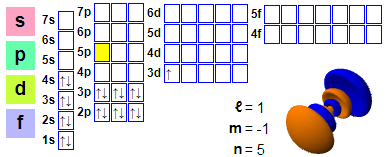
Configurazione elettronica
Configurazione elettronica: 1s2 2s2 2p6 3s2 3p6 4s2 3d1
Lo scandio è un metallo di transizione morbido, di colore bianco-argenteo, con punto di fusione di 1541 °C e punto di ebollizione di 2831 °C.
Per un considerevole periodo di tempo dopo la sua scoperta, l'uso dello scandio non è stato dimostrato a causa della sua difficoltà di produzione. Con il crescente miglioramento dei metodi di separazione degli elementi delle terre rare, esiste ora un flusso di processo maturo per la purificazione dei composti dello scandio. Poiché lo scandio è meno alcalino dell'ittrio e dei lantanidi, l'idrossido è il più debole, quindi il minerale misto di terre rare contenente scandio verrà separato dall'elemento delle terre rare mediante il metodo della "precipitazione a stadi", quando l'idrossido di scandio (III) viene trattato con ammoniaca dopo essere stato trasferito in soluzione. Un altro metodo consiste nel separare il nitrato di scandio mediante decomposizione polare del nitrato. Poiché il nitrato di scandio è il più facile da decomporre, lo scandio può essere separato. Inoltre, il recupero completo dello scandio associato da uranio, torio, tungsteno, stagno e altri giacimenti minerali rappresenta un'importante fonte di scandio.
Dopo aver ottenuto un composto di scandio puro, questo viene convertito in ScCl₅ e cofuso con KCl e LiCl. Lo zinco fuso viene utilizzato come catodo per l'elettrolisi, causando la precipitazione dello scandio sull'elettrodo di zinco. Successivamente, lo zinco viene evaporato per ottenere scandio metallico. Si tratta di un metallo bianco-argenteo leggero con proprietà chimiche molto attive, che può reagire con acqua calda per generare idrogeno gassoso. Lo scandio metallico che si vede nell'immagine viene quindi sigillato in una bottiglia e protetto con gas argon, altrimenti formerà rapidamente uno strato di ossido giallo scuro o grigio, perdendo la sua brillante lucentezza metallica.
Applicazioni
Industria dell'illuminazione
Gli usi dello scandio sono concentrati in direzioni molto luminose, e non è esagerato chiamarlo il Figlio della Luce. La prima arma magica dello scandio è la lampada al sodio scandio, che può essere utilizzata per portare luce a migliaia di case. Si tratta di una lampada elettrica agli alogenuri metallici: la lampadina è riempita con ioduro di sodio e triioduro di scandio, e vengono aggiunti contemporaneamente fogli di scandio e sodio. Durante la scarica ad alta tensione, gli ioni di scandio e gli ioni di sodio emettono rispettivamente luce alle loro lunghezze d'onda caratteristiche. Le linee spettrali del sodio sono 589,0 e 589,6 nm, due famose luci gialle, mentre le linee spettrali dello scandio sono 361,3~424,7 nm, una serie di emissioni di luce ultravioletta vicina e blu. Poiché si completano a vicenda, il colore della luce complessiva prodotta è luce bianca. Proprio perché le lampade al sodio scandio presentano le caratteristiche di elevata efficienza luminosa, buona tonalità di luce, risparmio energetico, lunga durata e forte capacità di schermatura della nebbia, possono essere ampiamente utilizzate per telecamere, piazze, impianti sportivi e illuminazione stradale, e sono note come sorgenti luminose di terza generazione. In Cina, questo tipo di lampada viene gradualmente promosso come nuova tecnologia, mentre in alcuni paesi sviluppati era ampiamente utilizzato già all'inizio degli anni '80.
La seconda arma magica dello scandio sono le celle solari fotovoltaiche, che possono catturare la luce diffusa sul terreno e trasformarla in elettricità per alimentare la società umana. Lo scandio è il miglior metallo barriera per celle solari e celle solari a semiconduttore, isolanti metallici e al silicio.
La sua terza arma magica si chiama sorgente di raggi γ A. Quest'arma magica può brillare intensamente da sola, ma questo tipo di luce non può essere percepito a occhio nudo, è un flusso di fotoni ad alta energia. Solitamente estraiamo il 45Sc dai minerali, che è l'unico isotopo naturale di scandio. Ogni nucleo di 45Sc contiene 21 protoni e 24 neutroni. Il 46Sc, un isotopo radioattivo artificiale, può essere utilizzato come sorgente di radiazioni γ o come tracciante per la radioterapia dei tumori maligni. Esistono anche applicazioni come il laser a granato di ittrio, gallio e scandio.Fluoruro di scandioFibra ottica a infrarossi in vetro e tubo catodico rivestito di scandio in televisione. Sembra che lo scandio sia dotato di luminosità innata.
Industria delle leghe
Lo scandio nella sua forma elementare è stato ampiamente utilizzato per il drogaggio delle leghe di alluminio. Aggiungendo pochi millesimi di scandio all'alluminio, si forma una nuova fase Al₂Sc, che svolge un ruolo di metamorfismo nella lega di alluminio e ne modifica significativamente la struttura e le proprietà. L'aggiunta di Sc dallo 0,2% allo 0,4% (che è molto simile alla quantità di sale che si aggiunge alle verdure saltate in padella a casa, ne basta una piccola quantità) può aumentare la temperatura di ricristallizzazione della lega di 150-200 °C e migliorarne significativamente la resistenza alle alte temperature, la stabilità strutturale, le prestazioni di saldatura e la resistenza alla corrosione. Può anche evitare il fenomeno di infragilimento che si verifica facilmente durante lavori prolungati ad alte temperature. Le leghe di alluminio ad alta resistenza e tenacità, le nuove leghe di alluminio saldabili ad alta resistenza e resistenti alla corrosione, le nuove leghe di alluminio ad alta temperatura, le leghe di alluminio ad alta resistenza e resistenti all'irradiazione di neutroni, ecc., presentano prospettive di sviluppo molto interessanti nei settori aerospaziale, aviazione, navale, reattori nucleari, veicoli leggeri e treni ad alta velocità.
Lo scandio è anche un ottimo modificatore per il ferro, e una piccola quantità di scandio può migliorare significativamente la resistenza e la durezza della ghisa. Inoltre, lo scandio può essere utilizzato anche come additivo per leghe di tungsteno e cromo ad alta temperatura. Naturalmente, oltre a essere utilizzato per realizzare abiti da sposa, lo scandio ha un alto punto di fusione e una densità simile a quella dell'alluminio, ed è utilizzato anche in leghe leggere ad alto punto di fusione come la lega di titanio e scandio e la lega di magnesio e scandio. Tuttavia, a causa del suo prezzo elevato, viene generalmente utilizzato solo in settori manifatturieri di fascia alta come quello degli space shuttle e dei razzi.
Materiale ceramico
Lo scandio, una sostanza singola, è generalmente utilizzato nelle leghe e i suoi ossidi svolgono un ruolo importante nei materiali ceramici in modo analogo. Il materiale ceramico di zirconia tetragonale, che può essere utilizzato come materiale per elettrodi nelle celle a combustibile a ossidi solidi, ha una proprietà unica: la conduttività di questo elettrolita aumenta con l'aumentare della temperatura e della concentrazione di ossigeno nell'ambiente. Tuttavia, la struttura cristallina di questo materiale ceramico di per sé non può esistere in modo stabile e non ha alcun valore industriale; è necessario drogare alcune sostanze in grado di fissare questa struttura per mantenerne le proprietà originali. L'aggiunta di ossido di scandio dal 6 al 10% è come una struttura di cemento, in modo che la zirconia possa essere stabilizzata su un reticolo quadrato.
Esistono anche materiali ceramici ingegneristici come il nitruro di silicio ad alta resistenza e ad alte temperature, usati come densificanti e stabilizzanti.
Come densificatore,ossido di scandioPuò formare una fase refrattaria Sc₂Si₂O₂ ai bordi delle particelle fini, riducendo così la deformazione ad alta temperatura delle ceramiche ingegneristiche. Rispetto ad altri ossidi, può migliorare maggiormente le proprietà meccaniche ad alta temperatura del nitruro di silicio.
Chimica catalitica
In ingegneria chimica, lo scandio viene spesso utilizzato come catalizzatore, mentre lo Sc₂O₂ può essere utilizzato per la disidratazione e la deossidazione di etanolo o isopropanolo, la decomposizione dell'acido acetico e la produzione di etilene da CO₂ e H₂. Il catalizzatore PtAl contenente Sc₂O₂ è anche un importante catalizzatore per i processi di idrogenazione, purificazione e raffinazione di oli pesanti nell'industria petrolchimica. Nelle reazioni di cracking catalitico come quella del cumene, l'attività del catalizzatore a zeolite Sc-Y è 1000 volte superiore a quella del catalizzatore a silicato di alluminio; rispetto ad alcuni catalizzatori tradizionali, le prospettive di sviluppo dei catalizzatori allo scandio sono molto promettenti.
industria dell'energia nucleare
L'aggiunta di una piccola quantità di Sc2O3 all'UO2 nel combustibile nucleare del reattore ad alta temperatura può evitare la trasformazione del reticolo, l'aumento di volume e la formazione di crepe causate dalla conversione di UO2 in U3O8.
Cella a combustibile
Allo stesso modo, aggiungendo dal 2,5% al 25% di scandio alle batterie al nichel-alcali ne aumenterai la durata.
Allevamento agricolo
In agricoltura, semi come mais, barbabietola, pisello, grano e girasole possono essere trattati con solfato di scandio (la concentrazione è generalmente compresa tra 10-3 e 10-8 mol/L, con concentrazioni diverse a seconda della pianta), ottenendo un effetto positivo sulla germinazione. Dopo 8 ore, il peso secco di radici e gemme è aumentato rispettivamente del 37% e del 78% rispetto alle piantine, ma il meccanismo è ancora in fase di studio.
Dall'attenzione di Nielsen al debito dei dati sulla massa atomica fino a oggi, lo scandio è entrato nella mente delle persone solo da cento o vent'anni, ma è rimasto quasi in disparte per un centinaio d'anni. Solo il vigoroso sviluppo della scienza dei materiali alla fine del secolo scorso gli ha dato nuova vitalità. Oggi, gli elementi delle terre rare, incluso lo scandio, sono diventati protagonisti assoluti della scienza dei materiali, svolgendo ruoli in continua evoluzione in migliaia di sistemi, apportando maggiore praticità alle nostre vite quotidiane e creando un valore economico ancora più difficile da misurare.
Data di pubblicazione: 29 giugno 2023